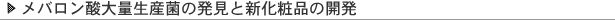私は1933年に東北地方の山村に生まれ、少年時代からカビとキノコに親しみ、大学では青カビからペニシリンを発見したアレキサンダー・フレミングの伝記に感銘を受けた。大学卒業(57年)から現在までの50年間、微生物の医薬と食品への応用研究を続けてきた。この間、21年余り(57-78年)を三共(株)で、18年間(79-97年)を東京農工大学で過ごし、定年退職(97年)後は小さな会社を起こして研究を続けている。
(1)コンパクチンの発見と開発
2年間のアメリカ留学(1966-68)で、先進国では動脈硬化性疾患である心筋梗塞と脳梗塞が主要死因のであることを知った。 当時、体内コレステロールの大半が肝臓で合成されることが知られていた。 更に留学時に他の研究者がHMG-CoA還元酵素がコレステロール合成の律速酵素であることを立証した。 そこでHMG-CoA還元酵素の阻害剤が有効なコレステロール低下剤になると考え、 帰国後の1971年4月に菌類から阻害物質を探すプロジェクトを立ち上げた。 2年間で6,000株余の菌類を調べ終えた73年7月に、青カビ(Penicillium citrinum Pen-51) からML-236B (コンパクチン、メバスタチン) を発見した (図1、2)。 コンパクチンは生体中ではラクトン型から酸型に変わること分かり、 酸型とHMG-CoAの構造の一部が似ていた(図2)。
1974年2月、ラットに1週間投与したが血中コレステロールが下がらないので、 担当した中央研生物グループの判定で、 開発が中止された。 我々はこの判定に納得せず、酸型とHMG-CoAの構造の一部が似ていることを手掛かりに, コンパクチンがラットに効かない原因を研究した。 ラットに効かないのは本酵素の拮抗阻害剤であるコンパクチンがラット肝のHMG-CoA還元酵素活性を6-10倍に誘導し、阻害作用を打ち消すのが主な原因と分かった。 コンパクチンが肝HMG-CoA還元酵素が誘導されたラットには効いたので、肝HMG-CoA還元酵素が誘導されていると予測した産卵鶏で投与したところ、 劇的に効くことが分かった。 更にイヌ、サルでも血中コレステロールに35-40%の低下が認められたので、76年8月に 開発が再開された。
翌77年4月、ラットの5週間の中期毒性試験で肝毒性があるとして、 再度開発が中止された。今回のトラブルは臨床医(阪大病院の山本章医師)の協力で重症患者を治療し, 薬効と安全性が確かめられたので、再度復活して、78年11月, 正規の臨床試験に入った。 臨床試験は極めて順調にフェーズ2まで進んだ。 私はコンパクチンの開発が一段落したら、大学へ移りたいと考えだったので、臨床試験に入った78年末に三共を退職し、79年初めから東京農工大学に勤務した。
並走中のイヌの2年間の長期毒性試験は、当初1年(52週間)の計画であった。それが39週後に何も異常がなかったことから、当時としては1年で十分なのに、理由もなく2年に延長された。 当初の1年の計画では、長期毒性試験では最高投与量を、直前に報道されたクロフィブレートの例に倣い、20mg/kgに抑えるきだとする、私たちの主張が無視されて、0、25、100と200 mg/kgの4群で、私が三共在職中の78年5月24日にスタートした。 その結果、25 mg/kgには異常なかったが、100と200 mg/kgの2群に発がん性が認められた、との噂がたった(事実らしい)。 本試験後の80年8月、三共はコンパクチンの開発から撤退した。 三共が次に開発したプラバスタチンの開発では、イヌの長期毒性試験では最高投与量を25mg/kgに抑えている。
 |
 |
|
(図1)ML-236B(コンパクチン)を生産するカビ(Penicillium citrinum Pen-51 )(左) (図2)HMG-CoA還元酵素反応(上)とコンパクチンのラクトントン型と酸型(右) |
|
(2)ロバスタチン(モナコリンK, メビノリン)の発見と開発
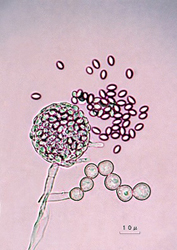
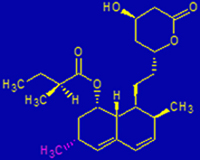
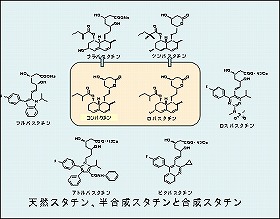
1976年7月、三共はメルクと秘密保持契約を結び、78年10月まで2年余、コンパクチンの結晶と非公開実験データをメルクに送り続けた。 我々はコンパクチンを両社で共同開発するものと思ったが、メルクは三共に断りなく、78年11月頃にAspergillus terreusからロバスタチン(メビノリンと命名)を発見し、79年6月に出願していた(図3)。 同じころ、遠藤は農工大で紅麹菌(Monascus ruber M1005 )からロバスタチン(モナコリンKと命名)を発見し(図3,4)、79年2月に出願し、権利を三共に譲渡した。 メルクがロバスタチンに発がん性のないことを証明して開発に成功し、商業化した(商業化スタチン1号)。 三共はモナコリンKを開発せず、出願した先願主義国(ドイツ、英国、日本など30か国)で対メルクの防衛特許に利用し、これらの国でのメルクのロバスタチンの開発を阻止できた。
ロバスタチンに続き6種のスタチンが開発・商業化された(図4,5)。 日本では上述の理由でロバスタチンは開発されなかった。 ロバスタチンの後に開発されたスタチンはすべて構造の活性中心部分が共有のコンパクチン誘導体である。
 |
 |
|
(図3)モナコリンK (ロバスタチン)の生産菌(Monascus ruber M1005)(左) と構造(右) |
|
 |
 |
|
(図4)ロバスタチンに次いで開発されたスタチン6種(日本では5種)(左) (図5)日本で開発されたスタチンの例(右) |
|
(3)モナコリンJの発見
遠藤はモナコリンKと共に側鎖のないモナコリンJを発見し、日本で出願した。 メルクは世界市場で販売できるシンバスタチンをロバスタチンに次いで開発した。 ロバスタチンからシンバスタチンを合成する中間体の一つがモナコリンJである。
(4)コンパクチンの新製造法
新しいコンパクチン(ML-236B)の生産菌を発見して、特許を出願した。この特許を合同酒精(現オエノングループ)がプラバスタチン(メバロチン)の後発品の開発に利用した。 農工大を定年退職後、コンパクチン(ML-236B)の製造法を更に進め、この技術を協和発酵がプラバスタチンの後発品の開発に利用した。
(5)スタチンのまとめ
スタチンは冠動脈疾患と脳卒中の予防と治療の特効薬として、毎日世界でS. Grundyによれば毎日4000万人近い患者に投与され、同じ青カビから発見されたペニシリンと並ぶ奇跡の薬と呼ばれている。 スタチンは患者に5年間投与する大規模臨床試験が27回行われている。 動員した患者は延17万人に及んだ。 その成績をまとめると、スタチンは血漿LDLコレステロール値1/3下げ、スタチンは心筋梗塞と脳梗塞の発症率を1/3下げ、生存日数を延長する。 スタチン治療で長生きできた人は何百万人になると言われている。 世界の死因で1位と2位を占める心疾患と脳卒中による死亡者が、先進国では最近30年で半減した(50%低下)したが、この半減に最も貢献したものの一つがスタチン製剤である。 スタチン製剤の総売上高は2005年に250億ドル(約3兆円)に達した。 その中にはアトルバスタチンのように世界市場最初の年間売り上げが1兆円超の製剤もある。 スタチンの発見と開発の詳細についてはウェブサイトの「遠藤とスタチンに関する論評・著書」などを参考に薦めます。
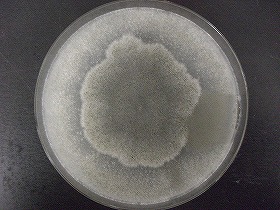
1957年に大学を卒業して三共に入社し、都内の食品工場の製造現場に配属。1年後に、果汁と果実酒の清澄化に用いる「ペクチナーゼ」という酵素の製造工程の合理化に成功。1年半後に、カビとキノコ250株の中からペクチナーゼの大量生産菌(Coniothyrium diplodiella)(図1)を発見し、入社2年後の59年春に商業化に成功。「スクラーゼS」の商品名で発売(図2)。その後6年間、ペクチナーゼの生化学研究に専念して、学位の取得と海外留学に備える(この間の64年に研究所に配転)(1,2)。
 |
 |
| (図1)Coniothyrium diplodiellaの ペトリ皿上の集落 (蓮見恵司提供) |
(図2)スクラーゼS剤 (現在の製品、諏訪桃子提供) |
- (1)三浦勇吉、遠藤章.ペクチン分解酵素剤.特公昭36-18088.1961年10月2日(1959年7月25 日出願).
- (2)(2)遠藤章.糸状菌のペクチン質分解酵素に関する研究.農化1966;40:R39-R44.
東京農工大学に移って1年後に、微生から歯垢形成阻害物質を探し、カビ(Aspergillus terreus)の1株(図1)から強力な阻害物質(ムタステインと命名)を発見(1)。その後、合同酒精(株)との共同で工業生産法を確立し、82年には日本歯科大学新潟歯学部の増原泰三教授との共同研究でムタステインがラットのウ蝕を予防することを証明(2)。(株)ロッテと共にムタステイン含有チューインガムを開発し(3)、86年に同社が「NOTIME」(左図)の商品名で発売(4, 5)(図2)。
 |
 |
| (図1)ムタステイン生産菌 (Aspergillus terreus) |
(図2)ムタステイン配合チュウインガム |
- (1)遠藤章.新生理活性物質ムタステイン及びその製造法.特公昭61-47515, 1986年10月20日(1981年3月6日出願).
- (2)中村康則、桑島治博、増原泰三、遠藤章.Streptococcus mutans 6715 株接種ラットにおけるMutasteinのう蝕抑制効果.Jpn J Oral Biol 1985; 27:603-610.
- (3)佐藤吉永、伊東禧男、大熊浩、 鈴木義久、遠藤章、長谷川安弘.ムタステイン配合チューインガム組成物.特公平3-71852, 1991年11月14日(1984年5月22日出願).
- (4)歯磨き不要のガム.バイオ活用し歯の表面洗浄. 東京新聞, 1986年9月23日.
- (5)虫歯予防剤が食品に-東京農工大遠藤教授・歯垢抑える物質抽出.朝日新聞, 1987年1月27日.
(1)新紅麹の清酒「続青春」
中国大陸と東南アジア諸国で数百年以上前から酒類の製造、食品の着色・保蔵、漢方に用いられてきた紅麹を、日本人の嗜好にあうように改良し、国内での普及を目的に取り組んだ研究テーマ(図1)(1)。1987年にヤエガキ酒造(株)(兵庫県)が新紅麹を用いた清酒「続青春」を発売した(図2)(2)。
 |
 |
| 図1 新紅麹 | 図2 新紅麹から造った清酒「続青春」 |
- (1)遠藤章.麹.特公昭60-44914 (1985年10月5日(1981年3月9日出願).
- (2)紅こうじ清酒-ヤエガキ酒造.バイオ産学協同-健康志向つかむ.日本経済新聞, 1987年2月7日(土).
(2)新紅麹を用いた健康食品
新紅麹菌発見を 、90年代半ばには山之内製薬(現アステラス製薬)との共同で健康食品の開発を進め、97年に発売した。その後数社がこの新紅麹を用いた健康食品を開発した(図1)(1)。
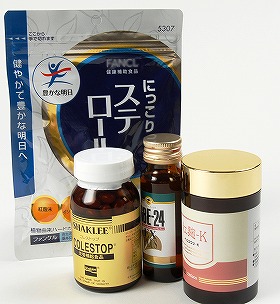 |
| 図1.新紅麹配合の数種の健康食品 |
- (1)遠藤章.紅麹と紅麹菌をめぐる歴史と最近の動向.発酵と工業.1985; 43: 544-552.
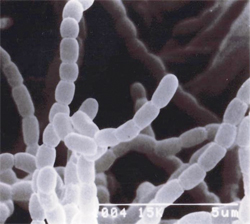
コラーゲンの加水分解酵素である新コラゲナーゼ(デイスコリシンと命名)を放線菌(Streptomyces sp.)(図1)から発見 (1)。(株)ヤクルト本社中央研究所との共同で製造法を確立し、86年に同社がガン治療薬の開発と生化学研究用試薬として発売(2)(図2)。
 |
 |
| (図1)新コラゲナーゼ生産菌 (Streptomyces sp.) |
(図2)新コラゲナーゼ剤のパンフレット |
- (1)遠藤章.新コラゲナーゼ、デイスコリシン及びその製造法.特公平5-16832, 1993年3月5日(1984年3月9日出願).
- (2)細胞生きたままで分離.ヤクルト、新酵素2種販売.日経産業新聞, 1986年10月31日ほか.
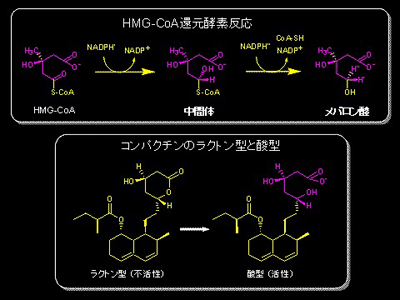
コレステロール合成の重要な中間体であるメバロン酸を大量生産する酵母を発見(1)。(株)ADEKAが量産に成功し(2)、カネボウ、京都府立医大がメバロン酸の保湿作用を証明(3)。99年にカネボウがメバロン酸を保湿成分とする新化粧品を発売(4)。
 |
 |
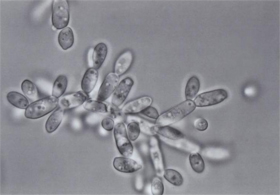
| (図1)メバロン酸を大量につくる酵母 (Saccharomycopsis fibrigera) |
(図2)メバロン酸(メバロノラクトン) 配合化粧品 |
コレステロール合成の重要な中間体であるメバロン酸を大量生産する酵母(Saccharomycosis fibrigera)(図1)を発見(1)。(株)ADEKAが量産に成功し(2)、カネボウ、京都府立医大がメバロン酸の保湿作用を証明(3)。99年にカネボウがメバロン酸を保湿成分とする新化粧品を発売(4)(図2)。
- (1)遠藤章、小池誠治.メバロン酸の製造方法.特公平7-51068, 1995年6月5日(1987年3月4日出願)ほか3件.
- (2)メバロノラクトン量産.旭電化、酵母菌で糖分分解―皮膚老化防止に効果.日経産業新聞,1999年11月11日.
- (3)Haratake A, Ikenaga K, Katoh N, et al. Topical mevalonic acid stimulates de novo cholesterol synthesis and epidermal permeability barrier homeostasis in aged mice. J Invest Dermatol 2000;114:247-252.
- (4)40-50歳代向けスキンケア用品.鐘紡新シリーズ.化学工業日報、日経産業新聞, 1999年9月17日ほか.
脳卒中は世界で年間600万人超が死亡する重大疾患である(WHO,2015)。出身地の秋田県は特に多く、当時日本一(ワースト)であった。祖父、両親も脳卒中で死んだ。大学生時代「秋田に多い古い味噌から昇圧物質を同定する」とする田杉甫(助手)の実験を手伝ってから、脳卒中に興味があった。脳卒中の大半を占める脳梗塞に有効な線溶系を活性化する物質を菌類から検索した結果、不完全菌・F165からプラクチンA-D(4種)、 Stachybotrys microspora IFO 30018からスタプラビンとその誘導体・SMTP同族体(SMTP-1-6)(1,2)、クロノスタチン,新規脂肪酸など10余の新規化合物を発見し、構造決定と作用を研究した。本テーマの共同研究者・蓮見恵司氏(東京農工大学農学部)はその後SMTP同族体の研究を更に進め、その一つが脳梗塞治療薬の開発を目指して、臨床試験フェーズ2まで進んでいる。
- (1)Shinohara C, Hasumi K, Hatsumi W, Endo A. Staplabin, a novel fungal triprenyl phenol which stimulates the binding of plasminogen to fibrin and U9937 cells. J Antibiot 1996; 49: 961-966.
- (2)Kohyama T, Hasumi K, Hamanaka A, Endo A. SMTP-1 and 2, novel analogs of staplabin produced by Stachybotrys microspora IFO 30018. J Antibiot 1997; 50: 172-174.
(完)